ファイザー製の新型コロナワクチンには、「切断型(truncated)mRNA」と呼ばれるmRNAの断片が含まれている。これは、命に関わる問題だ。驚くべきことに、ファイザー社は、複数の保健当局に偽造したmRNAの分析報告書を提出していた。
欧州医薬品庁(EMA)は2020年12月のワクチンの条件付承認を前に、切断型mRNAの問題を理由に「重大な異議」を提起していた。いったい何が起こっていたのか。これらの問題は、どのように解決に至ったとされたのか。2回にわたる連載記事で、この問題を深く掘り下げ、健康に対する潜在的な影響について検証していく。(後編はこちら)
概要
- 欧州医薬品庁(EMA)は、ファイザー製の新型コロナワクチンに「切断型(truncated)mRNA」が含まれていることを理由に、承認の妨げとなる「重大な異議」を提起した。
- ファイザー社は、自社製ワクチンに含まれる切断型mRNAの有害な結果について調査していない。
- ファイザー社が米食品医薬品局(FDA)とEMAに提出したウェスタンブロットの数値は、実際の実験からではなく、デジタル処理で作成されたものだった。
- この問題に対して、保健当局の行動は憂慮すべきほど欠けている。
- 切断型mRNAは、スパイクタンパク質による線維状の血栓や自己免疫疾患、癌など、複数のワクチン関連傷害に関与している可能性がある。
- ファイザー製ワクチンに関するこれらの問題によって、バッチごとに製品の品質に大幅な差が出ている可能性がある。これにより、ワクチン接種者が経験する有害事象の違いを説明できる。(バッチ:一つの生産サイクルで一度に生産される単位)
- 製薬会社や保健当局によるこのような無責任な行為の根本的な原因は、倫理の欠如にある。
スーパーマーケットで子供用の牛乳を10本買うとしたら、それぞれに同じ化学物質が含まれ、濃度も同じくらいだと考えるのが普通だ。5本には水で薄めた牛乳が、残りの5本にはヨーグルトが入っているとは誰も思わない。
市販の食品の多くは、規制や品質管理によって私たちの期待に応えている。同様の基準は、ワクチン製品を含む製薬業界にも存在している。
私たちは、医薬品やワクチン製品に対し、異なるバッチでも、主要成分の物理的・化学的パラメータが一貫していることを期待している。一貫性こそが、患者や消費者が医薬品の安全性と有効性に信頼を寄せるための土台だ。
医薬品製造の承認を申請するには、CMC(化学・製造・品質管理:Chemistry, Manufacturing and Control)と呼ばれる一連のプロセスが必要となる。そのプロセスには、製品の安全性と、バッチ間の一貫性を確保するために、従わなければならない製造方法と製品仕様の定義が含まれる。これは、世界の保健当局が医薬品やワクチンを承認する際の必須基準となっている。
従来の化学製品の品質管理は比較的簡単だが、mRNAのような生物学的製品の場合は、より複雑になる。
切断型mRNAとは何か、なぜ問題なのか
私たちのDNAには、ヌクレオチドからなる遺伝コードが含まれており、DNAはアミノ酸からなるタンパク質を作る。その遺伝コードとタンパク質の間には、メッセンジャーRNA(mRNA)と呼ばれる分子、いわば「翻訳者」が介在している。
ファイザー製ワクチンの有効成分は、スパイクタンパク質の全長をコードする、4284個のヌクレオチド残基からなるmRNAだ。
このmRNAは、スパイクタンパク質への翻訳を促進するために、天然のmRNAと同じ「5′キャップ」と呼ばれる構造を持っている。自動車に例えるなら、これはエンジンをかけるための点火装置だ。そして、翻訳領域であるオープンリーディングフレームの末端にある終止コドンが、自動車で言うところのブレーキの役割を果たす。もし、切断型mRNAに終止コドンがなければ、ブレーキのシグナルを出すことができず、タンパク質の翻訳プロセスは延々と続くことになる。
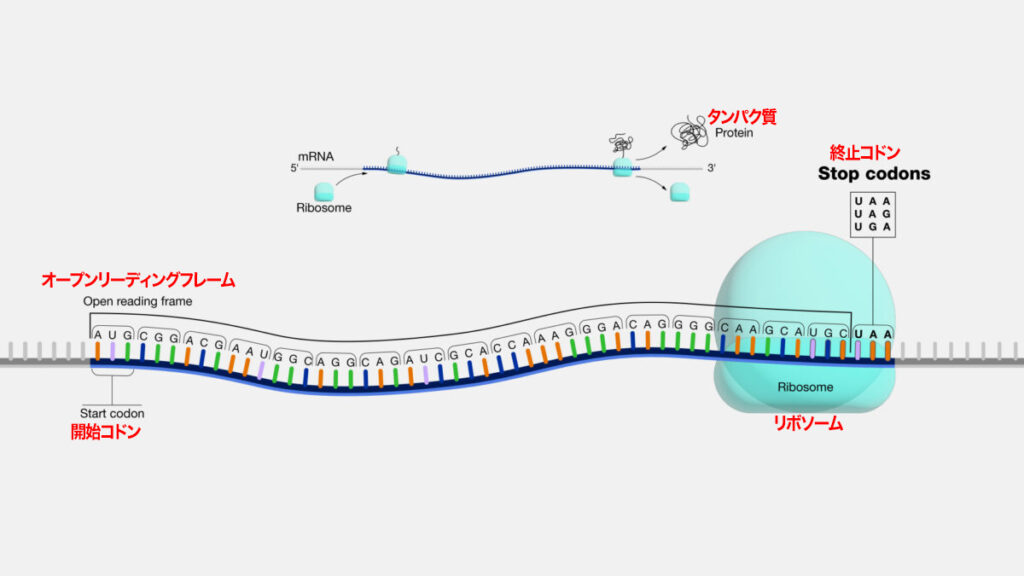
終止コドンを持たない切断型mRNAは、人間にとって非常に有害であり、有毒なタンパク質の産生に繋がりかねない。
ファイザー製ワクチンに含まれる切断型mRNA
欧州医薬品庁(EMA)は、医薬品やワクチンなど、欧州で人に使用されるすべての医薬品を承認する責任を負っている。欧州医薬品委員会(CHMP)が、EMAの見解をまとめる役割を担っている。
EMAは、「EMA/CHMP/448917/2021」というコードが付けられた評価報告書の中で、ファイザー製ワクチン中の不純物を「切断・修飾されたmRNA」と表現し、それに対処するよう同社に要請している。
ファイザー社がEMAに提出した報告書には、同社製ワクチンに不純物が含まれていると明確に示されていた。EMAの2021年8月の報告書のp14に記載されたグラフで、「Peak 1」に示された通りだ。以下はそのスクリーンショットである。
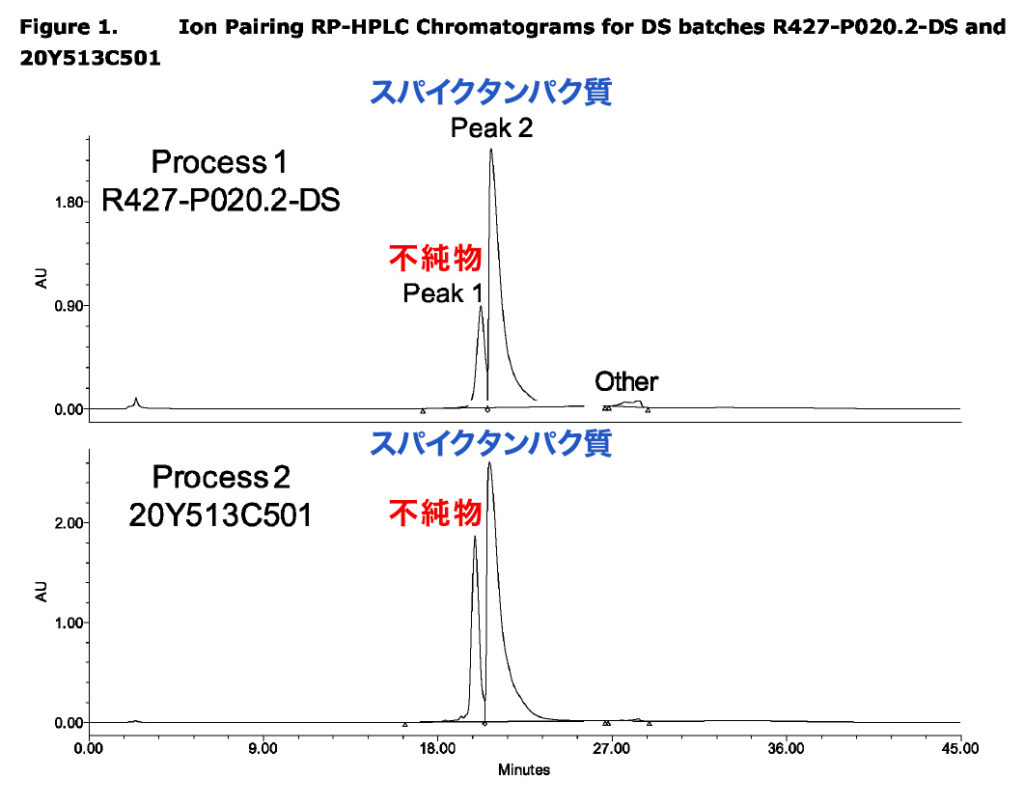
EMAはファイザー社に対し、分子模倣メカニズムにより自己免疫疾患を引き起こす、切断されたスパイクタンパク質/ペプチドなどの生成の可能性に関するデータを、毎月提出するよう要求していた。締め切りは2021年7月とされ、中間報告書の提出は2021年3月までとされていた。
EMAが切断型mRNAに「重大な異議」申し立て
「EMA/707383/2020」というコードが付けられた2021年2月19日付のEMAの評価報告書「Comirnaty, COVID-19 mRNA vaccine (nucleoside-modified) 」のp15、「製造業者、工程管理及び特性評価」の項目には、次のような記載がある。
「手続きにおいて、活性物質の製造に係るGMPステータス、及びバッチリリースを目的とした完成品の試験場のGMPステータスに関連するいくつかの問題が強調された。これらの問題は、重大な異議(MO)として分類された」
「重大な異議」とは、EMAによる正式な規制上の危険信号だ。これが解決されなければ、販売許可は与えられない。
つまり、上記の2本の報告書にある通り、切断型mRNAは長らく議論されてきたのだ。これらの生物剤が世界に展開される前に、EMAの審査官は切断型mRNAの問題を特定し、「重大な異議」を申し立てていた。
昨年6月、医療ニュースメディア「Trial Site News」が発表した調査報告書では、ファイザー/ビオンテックとEMAの会合で提示されたスライドがリークされた。今年1月10日、ファイザー社のほか多くの企業と仕事をした経験がある元製薬業界幹部のサーシャ・ラティポワ氏が、そのスライドをサブスタックに掲載している。
スライドから、EMAがファイザー社に対し問題に対処するよう要求していたことが分かる。以下の通りだ。
「切断された形態は、特性が十分に示され、記述されるべきであり、その断片にバッチ間での類似が予想されるか否かが議論されるべきだ。さらに、切断型、あるいは修飾型mRNAから生じる、意図したスパイクタンパク質(S1S2)以外の翻訳されたタンパク質の可能性に対処し、可能であれば、関連するタンパク質の特性評価データを提供する必要がある」
ファイザー社はワクチン中の切断型mRNAを認識していた
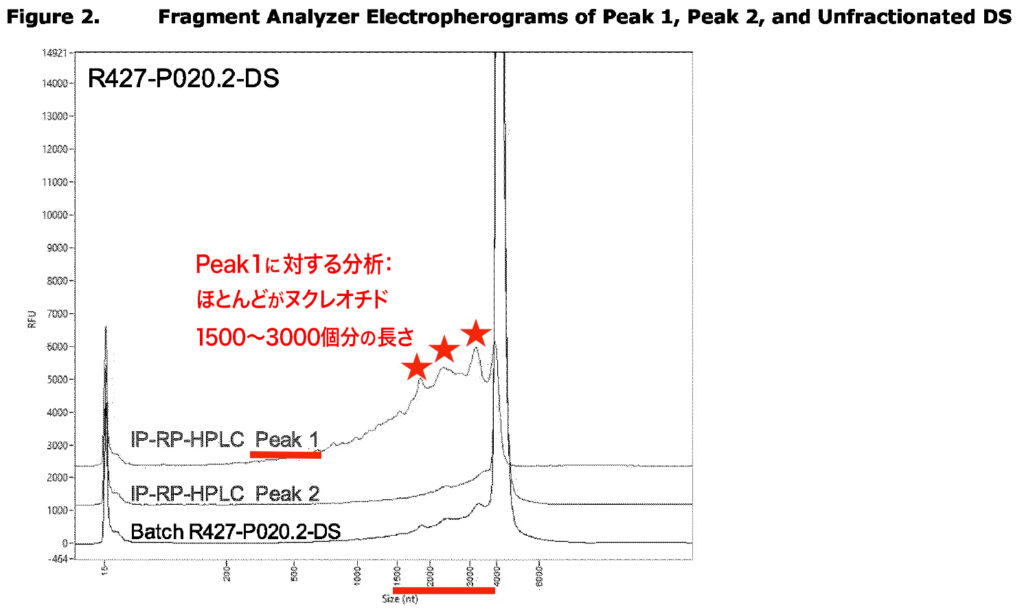
ファイザー社は、自社製ワクチンに含まれる切断型mRNAを完全に認識していた。ほとんどの切断型mRNAは、5′キャップを持ち、長さはヌクレオチド1,500〜3,500個分で、ポリA鎖と終止コドンを欠いている。これらは、スパイクタンパク質の一部分へと翻訳される。
残念ながら、mRNAによる翻訳が終点まで行っても、停止信号が与えられていないため、アミノ酸鎖の延長が止まらない。細胞内にはたくさんのmRNAが存在するが、停止信号がないと、理論上、細胞内の別のmRNAがやり残した仕事を引き継ぎ、スパイクタンパク質を延命させることになる。
同じmRNAに引き継がれれば、複数の反復を持つスパイク様タンパク質が引き続き形成される。異なるmRNAに引き継がれれば、未知のタンパク質が作られる。
下の注釈付きグラフは、EMAによる昨年8月付の報告書p15のスクリーンショットをもとに作成したものだ。
ファイザー社は、切断型mRNAがポリA鎖を欠いていたことも認めている。以下の注釈付きグラフは、同報告書p17のスクリーンショットを基に作成したものだ。
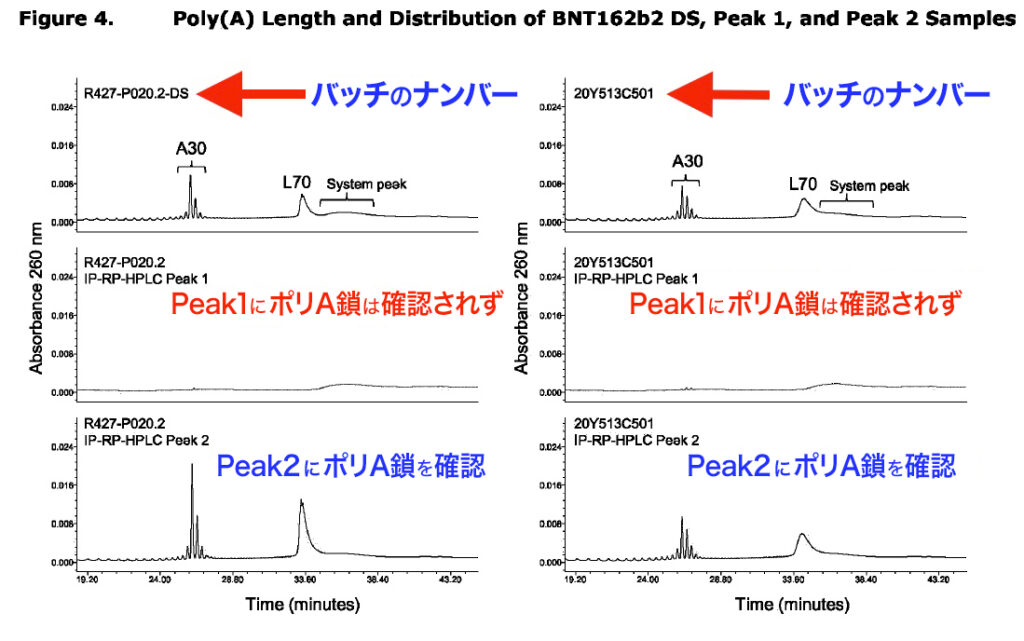
驚くべきことに、同報告書では、Peak 1における不純物の正確な割合を示す値が黒塗りにされていた。
下の注釈表は、同報告書p17のスクリーンショットに基づくものだ。
ファイザー社、デジタル処理されたウェスタンブロット画像をFDAとEMAに提出
「ウェスタン・ブロット法」は、特定のタンパク質を可視化する方法であり、研究者はタンパク質のサイズと存在量を確認することができる。
誤ったスパイクタンパク質が予期せぬ傷害を引き起こすことが懸念されるため、EMAはファイザー/ビオンテック社に対し、切断された新型コロナワクチンのRNAがタンパク質の断片を生成しないことを証明する実験結果を提出するよう要求した。
EMAが要求したのは、ヒトに使用されることを意図したあらゆるmRNA製品に対応すべき、基本的で最小限の懸念事項だった。
しかし、mRNAを予防ワクチンとして大規模集団に使用するのは今回が初めてであり、このような品質問題が浮上したのも初めてのことだった。切断型mRNAのリスクを管理するための規制上の品質基準が以前から存在したのかどうかは、私たちには分からない。
これらのRNA断片を特徴付けるのは配列決定だけだが、ファイザー社は、報告書に切断型mRNAの詳細な配列は報告しておらず、大まかな塩基数のみを報告している。
2020年12月、ファイザー社は、新型コロナワクチンが誘発するスパイクタンパク質のレベルを表すウェスタンブロット画像をFDAに提出し、ワクチンはその他のタンパク質を生成しないと主張した。
同報告書p39のスクリーンショットから、ファイザー社が作成した図の例を以下に示す。同社は、mRNAワクチンによって発現したタンパク質のサイズを評価し、次のように結論付けている。
「発現したタンパク質のサイズは、翻訳されたmRNAワクチン由来の物質の予想サイズと一致し、テストされた全てのバッチで同等だった」
しかし、このグラフはデジタル処理、あるいはコンピュータで作成されたものに見える。その評価理由は後ほど説明する。

2020年にファイザー社が提出したウェスタンブロット画像(FDA)
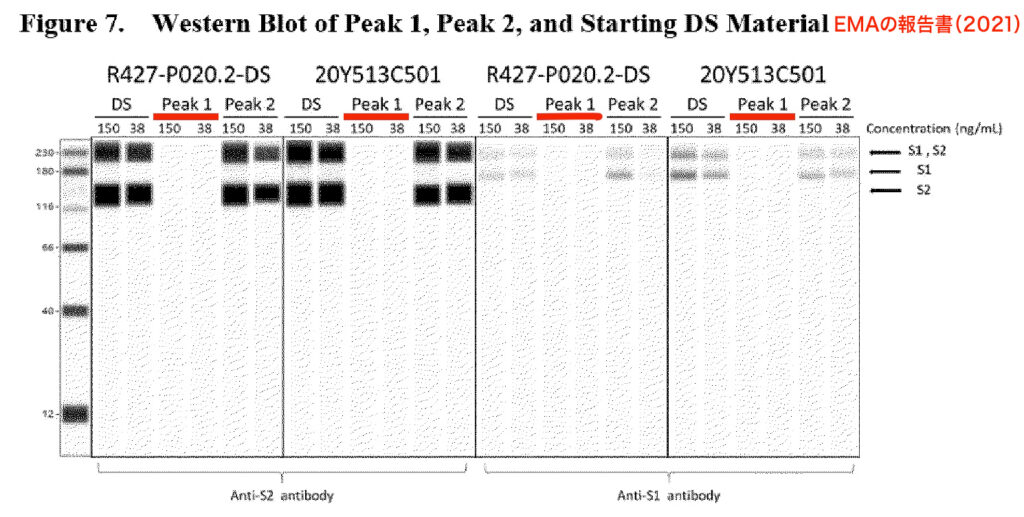
また、ファイザー社が2021年にEMAに提出したウェスタンブロットから、3例を以下に示す。
まず、一つ目のウェスタンブロットでは、試験管内の切断型mRNAが、Peak 1においてタンパク質を生成しないことが示された。下の注釈付き図は、EMAの報告書p19のスクリーンショットを基に作成したものだ。しかし、この画像も、2020年12月に発表されたものと同様に、デジタル処理、あるいはコンピュータで作成されたものだった。
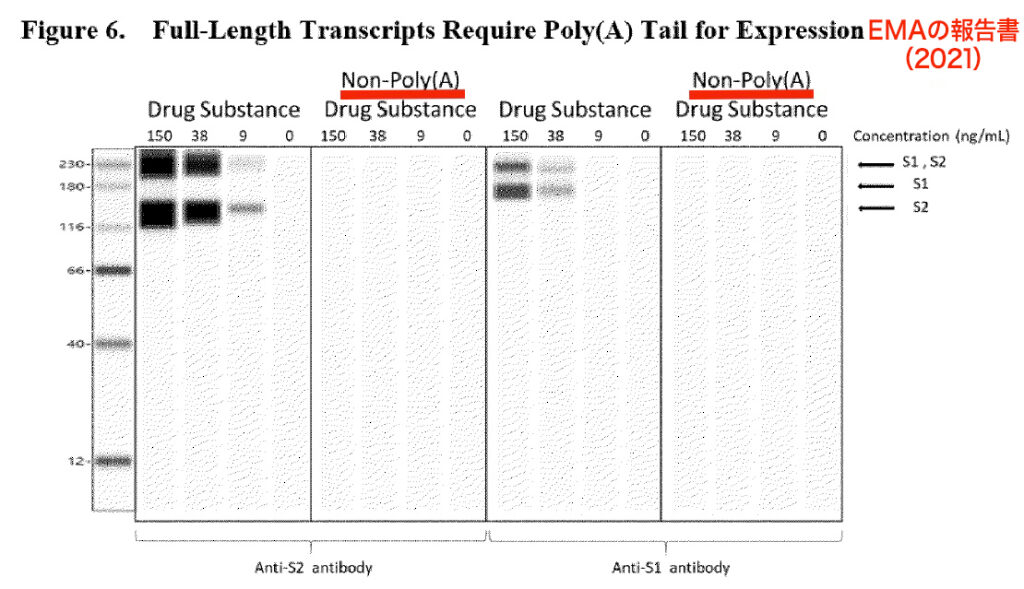
また、ファイザー社は、以下の2つのグラフを使用して、完全長の転写産物は発現にポリAを必要とすると説明したが、ウェスタンブロットはコンピュータで生成されている。下の注釈付き図は、2021年8月のEMAの報告書p18のスクリーンショットを基に作成した。

ファイザー社によって偽造されたこれらのウェスタンブロットは、少なくともFDA、EMA、豪州医薬品行政局(TGA)を含む世界の規制機関に提出された。
偽造だとなぜ分かるのか?
ウェスタンブロッティング技術の最初のステップでは、分子生物学分野で広く利用されている「ゲル電気泳動」によって、サンプル中のタンパク質が分離される。
タンパク質ごとに大きさも分子量も異なるため、同じ電場にかけると、異なる速度で一方の極から他方の極へと移動する。これは徒競走に例えることができる。
400メートル走のように、スタート地点にタンパク質が一列に並び、一定時間の経過とともに、小さなタンパク質が大きなタンパク質よりも速く進み、次第に「バンド」と呼ばれる異なる位置で異なるタンパク質が分離していく。これは、400メートル走で速度ごとにランナーが次々と離れていくのと同じだ。
ウェスタンブロットの結果を左右する要因には、タンパク質の移動速度、潜伏時間、抗体濃度などがある。そのため、実際のウエスタンブロットでは、完全なものはほとんどなく、常に何らかの歪みがある。
ウェスタンブロットは通常、少し「スマイル」(端が上向きにカーブ)し、尾を引いてにじみ、端が丸くなり、バーが不揃いになる。これらはしばしば、試料に含まれる塩分や、電荷を持つタンパク質の濃度が高さゆえに、その近傍の電場強度が変化し、移動に影響を与えるためだ。
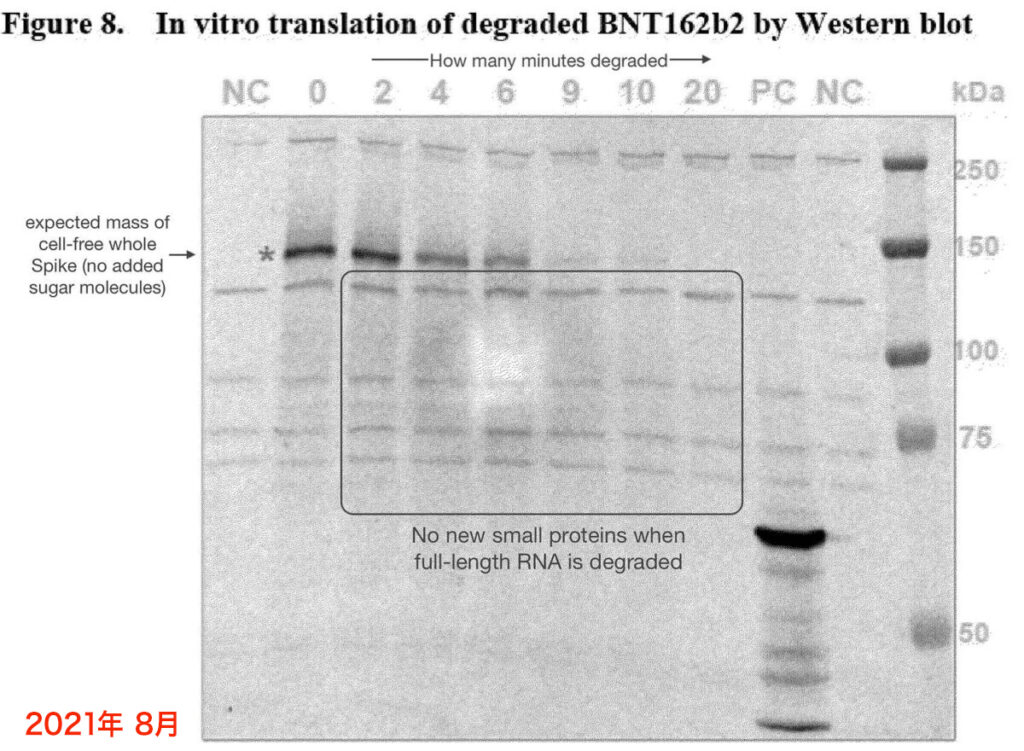
例えば、2021年のEMAの報告書に掲載されたウェスタンブロットのグラフ(下図)は、実際の実験から得られたもののように見える。ゲルとメンブレン(膜)の間に気泡ができることはよくあり、Figure 8の中央付近にある明るいスポットもおそらくそうだ。明暗ができることはよくある。
これは、EMAの報告書の中で唯一、実際の実験から得られたと思われるウェスタンブロットのグラフだ。しかし、ファイザー社は、この問題に関して、なぜ同じ報告書に2組のウェスタンブロットのグラフを記載してEMAに提出したのかは説明していない。
ファイザー/ビオンテック社が提供した、新型コロナワクチンが誘発するスパイクタンパク質のウェスタンブロットの多くは、非の打ち所のない完全な長方形をしていた。
先ほど引用した3つのウェスタンブロット(Figure 5, 6, 7)はいずれも、偽物のように見える。すべてのバンドがレーンにきれいにとどまっており、完璧に規則正しく、完全にノイズが除去されているからだ。
大紀元はファイザー社にコメントを求めたが、記事作成までに回答は得られていない。
EMA、決定的な結論が出ないにもかかわらず承認
また、EMAは同報告書の中で次のように述べている。
「断片化したRNA は、安定性や翻訳効率が悪いことが予想されるため、発現タンパク質にならない可能性が高い(後述)。しかし、切断型RNAと発現したタンパク質に関する実験データがないため、決定的な結論は出ず、さらなる特性解明が必要である。したがって、特定の義務として、追加の特性評価データを提供することが残されている(SO1)」
偽の報告書を信頼できる実験データと解釈し、規制当局による承認の裏付けとして信用する人がいるだろうか。
それにもかかわらず、2021年8月のEMAの報告書のp22とp23には、「これらの問題は解決されたと考えられる」と記載されている。では、どう解決されたとみなされるのだろうか。あのインチキなウェスタンブロットに基づいているのだろうか。
ところが、EMAは2020年12月12日に、ファイザー/ビオンテックに条件付き販売許可を与えている。
後編では、この品質問題の意味と、ワクチン関連傷害の潜在性について引き続き議論していく。
記事作成に際して、Joe Wang博士のレビューとコメントに感謝します。
本記事は情報提供を目的としたものであり、個別の医療上のアドバイスに代わるものではありません。個人の医療上のアドバイス、診断、治療については、信頼できる専門家にご相談ください。








 ご友人は無料で閲覧できます
ご友人は無料で閲覧できます Line
Line Telegram
Telegram



ご利用上の不明点は ヘルプセンター にお問い合わせください。